《癌细胞》:死了还要搞鬼?最新研究发现,癌细胞凋亡后的残骸被特殊巨噬细胞吞噬,可激活IL-33信号导致免疫抑制
来源:奇点糕 2025-03-10 09:16
癌细胞被化疗、靶向治疗等抗癌治疗手段诱导发生凋亡后,留下的残骸进入肿瘤引流淋巴结(TDLNs)内,会被特殊巨噬细胞亚群——髓窦巨噬细胞(MSMs)吞噬清除。
记得在几个月前聊到癌细胞“阴魂不散”,凋亡后仍可释放细胞因子导致免疫抑制的时候,奇点糕就在心里暗暗吐槽过,癌细胞这表现简直是“死了都要爱”的反义词,就算死了还可以作妖。但是啊,奇点糕还是把癌细胞想得太简单了,跟今天Cancer Cell期刊最新发表论文揭示的癌细胞最新“亡语”一比[1],释放细胞因子的招数,真的只能算是小儿科。
来自多伦多大学团队的研究成果显示,癌细胞被化疗、靶向治疗等抗癌治疗手段诱导发生凋亡后,留下的残骸进入肿瘤引流淋巴结(TDLNs)内,会被特殊巨噬细胞亚群——髓窦巨噬细胞(MSMs)吞噬清除,但MSMs吞噬残骸后会释放白介素-33(IL-33),以此促进TDLNs内的调节性T细胞(Treg)活化成熟、迁移到肿瘤部位,进而抑制CD8+T细胞的抗肿瘤免疫功能。
由IL-33信号调控的上述免疫抑制过程,虽然是人体维持自体免疫稳态,避免随时随地都在凋亡的大量正常细胞激活异常免疫应答的重要机制,但显然不利于各种抗癌治疗起效,可以说也有点颠覆过去“癌细胞残骸可增强免疫应答”的认知。针对IL-33或其受体ST2进行干预,则有望消解免疫抑制的不利影响,助力免疫治疗以及其它抗癌治疗手段。
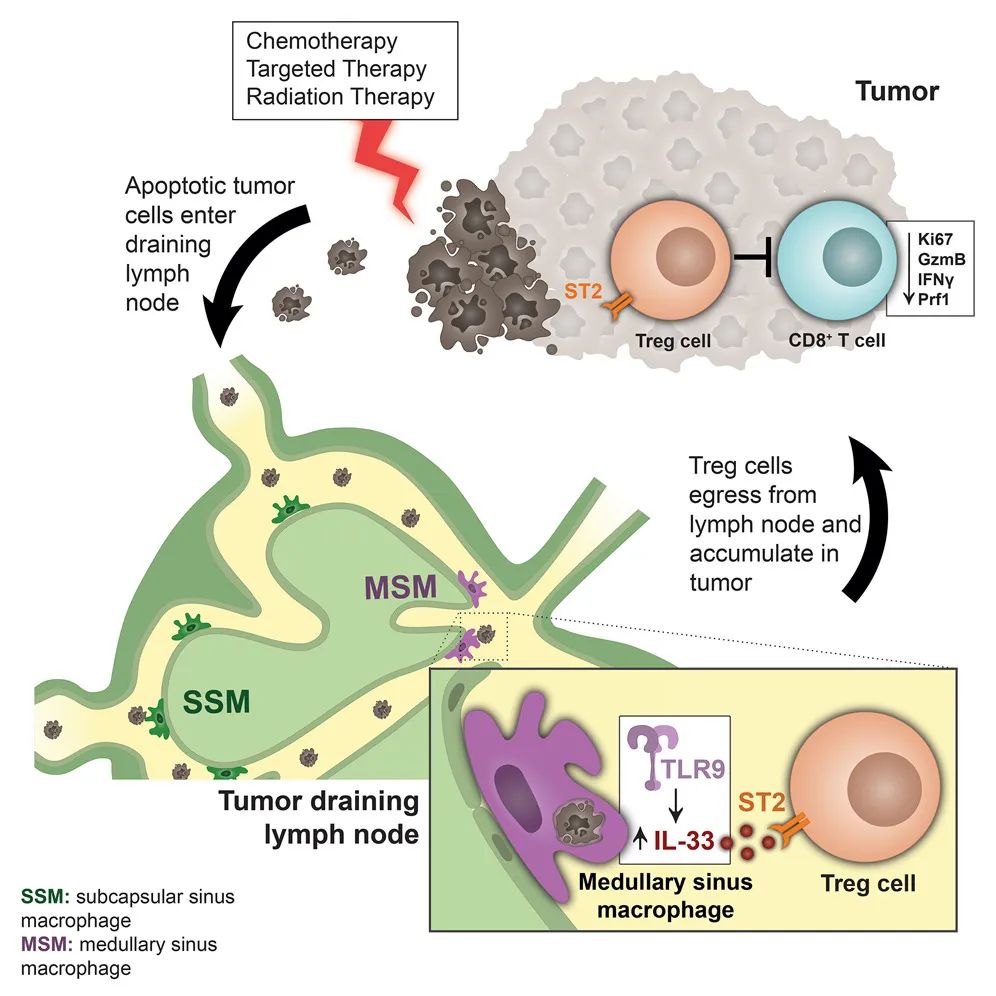
一图总结论文核心内容
其实如果只从免疫稳态的角度来思考,人体内存在像本次研究一样描述的免疫抑制通路是相当合理的,毕竟每天会有数百亿个细胞发生凋亡[2],癌细胞在其中的占比说是九牛一毛都多,免疫系统也不能见到凋亡细胞就活跃起来,不然自身免疫就停不下来了。而负责用吞噬功能来清除凋亡细胞残骸的巨噬细胞,本来也常常发挥免疫抑制作用,那一事不劳二主呗。
但上面说的进程如果发生在肿瘤微环境,影响可就完全不同了。估计读者们肯定知道,化疗、放疗等治疗手段本身的起效机制,以及能与免疫治疗协同增效的关键,往往就是诱导癌细胞凋亡,让癌细胞变成具有免疫原性的一堆残骸,要是巨噬细胞赶过来,边吃边导致免疫抑制,那还得了?当然得找到具体负责的巨噬细胞,让它们“住嘴”才行。
多伦多大学团队首先使用顺铂治疗黑色素瘤模型小鼠,再进行流式细胞术分析,评估癌细胞残骸流入TDLNs后被各类免疫细胞吞噬的情况,证实MSMs是吞噬残骸的最主要群体,此前学界对它们的生理功能还知之甚少,这就顺带着破案了。而吞噬完残骸后,MSMs内的PD-L1等免疫调节相关分子表达也明显上调,说明它们在功能上向免疫耐受表型转变。
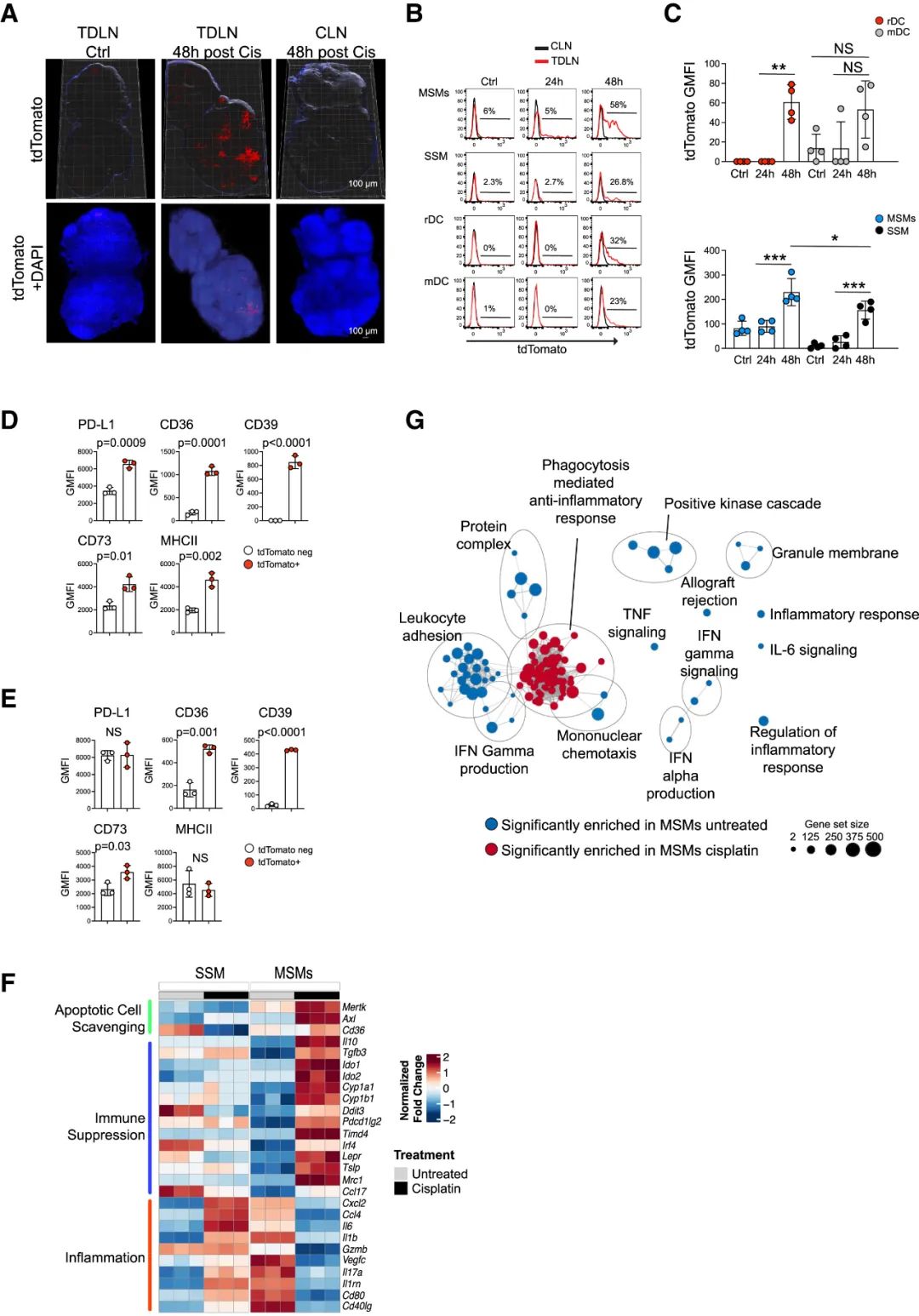
MSMs主要负责在TDLNs中吞噬癌细胞残骸,并向免疫耐受表型转变
转录组学分析则显示,IL-33在顺铂处理后48小时内表达上调最为显著,且TDLNs内的MSMs是表达上调的唯一来源,直接注射凋亡癌细胞也可诱导MSMs产生IL-33;上游调控IL-33表达的是Toll样受体9(TLR9),且该过程依赖于MSMs吞噬功能保持正常。敲除MSMs的Il33表达或使用阻断其相应受体ST2的单抗,即可有效增强CD8+T细胞的抗肿瘤效应功能,进而改善顺铂治疗的效果,减轻小鼠肿瘤负荷。
而正如奇点糕开头所说,通过诱导凋亡来抗癌的药物可不只有顺铂这种化疗药,研究者们接下来又证实,治疗黑色素瘤常用的靶向药BRAF抑制剂,疗效也会被MSMs产生的IL-33所限制,所以没有IL-33才利好抗癌。
或者…更准确地说,没有响应IL-33信号的Tregs就够了,正是它们受MSMs吞噬癌细胞残骸后产生的IL-33调控,活化、成熟,再从TDLNs迁移到肿瘤部位,才抑制了CD8+T细胞的抗肿瘤免疫功能,削弱抗癌治疗效果。

MSMs产生的IL-33主要通过激活Treg迁移到肿瘤部位,限制抗肿瘤免疫应答
最后研究者们也确认,人类黑色素瘤患者中同样存在MSMs吞噬癌细胞残骸、表达IL-33抑制免疫应答的现象,且被该进程激活的Tregs基因特征与患者生存预后相关,那相应干预策略相信也不用奇点糕多说,让针对IL-33/ST2的抗体药物出马,或许能惠及形形色色的治疗手段或者联合治疗呢
参考文献:
[1]Lamorte S, Quevedo R, Jin R, et al. Lymph node macrophages drive immune tolerance and resistance to cancer therapy by induction of the immune-regulatory cytokine IL-33 [J]. Cancer Cell, 2025.
[2]Kakarla R, Hur J, Kim Y J, et al. Apoptotic cell-derived exosomes: messages from dying cells[J]. Experimental & Molecular Medicine, 2020, 52(1): 1-6.
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


